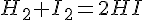平衡转化率概念转化率a=
(某反应物已消耗的浓度/反应物起始浓度)×100%
或(某反应物已转化的量/反应开始时该反应物的总量)×100%
反应的自发性与反应的可能性是不同的概念
标准平衡常数多重组合
平衡常数只与温度有关
0
温度计算
化学反应自发式方向转变的温度计算,要利用表中数据来讨论温度变化时对反应的影响
ΔG与ΔH,ΔS,T有关,可以利用ΔG判断化学反应方向的自发性。ΔG<0正向自发进行。
2.ΔG越小,反应的倾向性越大。
3.可利用热力学函数变化值判断化合物的相对稳定性。
可逆反应:在同一个条件下,同时向正、逆两个方向进行的反应。大多数的化学反应都是可逆的。
化学平衡的特点:只要条件不变,体系中各物质的量不随时间变化而变化。
转化率:α=(某反应物已消耗的浓度/反应物起始浓度)×100%=(某反应物已转化的量/反应开始时该反应物的总量)×100%
化学平衡的主要特点:1、V正=V逆。2、是一种动态平衡。3、是有条件的平衡。4、平衡组成与达到平衡的途径无关。
化学反应自发方向转变的温度计算,注意大于或小于符号,特别注意计算单位的统一。
标准平衡常数多重组合 。