焓的计算公式
焓的计算公式
化学热力学规定了物质的标准状态。
热力学标准态并无温度的规定。
反应的焓变与化学计量方程式之间要隔开。
反应的焓变与化学计量方程式之间要对应。
在标准状态下,由最稳定的纯态单质生成1mol 的某物质时的焓变,称为该物质的标准摩尔生成焓。
焓的定义:H=U+PV(H为焓,因U、P、V均为状态函数,所以H也是状态函数)
化学反应的焓变△H:能测定的是状态改变时焓的改变值△H称焓变。
对于化学反应,始态为反应物,终态为产物(△H>0,吸热反应;△H<0放热反应)
在恒压及反应始、终态温度相等的条件下,反应热等于生成物与反应物的焓差,即恒压反应热等于体系的焓变。
标准摩尔焓变:在热力学标准状态下,发生1摩尔化学反应的焓变。
标准摩尔焓变与化学反应方程式的写法有关。
反应的焓变与化学计量方程式之间要隔开。
反应的焓变与化学计量方程式之间要对应。
重点:1、标准摩尔焓变与化学反应方程式的关系
2、反应的焓变与化学计量方程式之间要隔离
3、反应的焓变与化学计量方程式之间要对立
焓:H=U+PV
W=-P(V2-V1)=-P*△V
△U=(U2+PV2)-(U1+PV1)
体积功:是反抗外压力而改变;
焓的定义:对气体参加或生成的反应,可能会引起体积变化(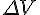 ),则体系对环境作功:
),则体系对环境作功:
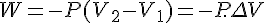
H成为焓,因U、P、V均为状态函数,所以H也是状态函数。
在恒压及反应始、终态温度相等的条件下,反应热等于生成物与反应物的焓差,即恒压反应热等于体系的焓变。
标准摩尔焓变与化学反应方程式的写法有关。
在标准状态下,由最稳定的纯态单质生成1mol的某物质时的焓变,称为该物质的标准摩尔生成焓。单位为千焦每摩尔,T通常为298.15K。
注意:三个环节,首先是标准状态下,其次是最稳定的纯态单质,最后是形成1mol的某物质的时焓变。
在绝对焓值无法求得的情况下,如何计算化学反应
物质标准状态:
气体——100KPa
液体、固体——1mol/L
反应热效应-焓
恒压热效应
因为UPV都是状态函数,所以H也是状态函数。
都要在标准摩尔下进行
都在热力学状态下进行
吸热反应,放热反应